- Дихромат натрия
-
Дихромат натрия 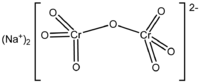
Общие Традиционные названия динатриевая соль дихромовой кислоты, динатрий дихромат(VI) Химическая формула Na2Cr2O7 Физические свойства Состояние (ст. усл.) красные до оранжевых гигроскопичные кристаллы Молярная масса (ангидрид) 261.968 г/моль
(дигидрат) 298.00 г/моль
Плотность 2.52 г/см³ Термические свойства Температура плавления (ангидрид) 356.7 °C
(дигидрат) около 100 °C
Температура разложения 400 °C Энтальпия образования (ст. усл.) -1962 кДж/моль Химические свойства Растворимость в воде (при 20 °C) 236 г/100 мл Растворимость в остальных веществах растворим в спирте Классификация Рег. номер CAS 10588-01-9,
(дигидрат) 7789-12-0
Номер ООН 3288 Регистрационный номер EC 234-190-3 RTECS HX7750000 (ангидрид, дигидрат) Безопасность ЛД50 50 мг/кг Токсичность Дихрома́т на́трия (бихромат натрия, натриевый хромпик) — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия( Na2Cr2O7·2H2O) и безводная соль.
Полупродукт в производстве хрома, практически вся хромовая руда перерабатывается в дихромат натрия.
Содержание
Свойства
Химические
С точки зрения реакционной способности и внешнего вида дихромат натрия и дихромат калия очень похожи. Соль натрия, однако, в двадцать раз лучше растворяется в воде, чем соль калия (49 г/л при 0 °C) и ее эквивалентная масса также меньше — поэтому она является наиболее часто используемым веществом.
Схожестью хромовой кислоты и дихромата натрия является их общее свойство — они являются окислителями. По отношению к калийной соли, основным преимуществом бихромата натрия является его большая растворимость в воде и в полярных растворителях, например таких как уксусная кислота.
В области органического синтеза это соединение окисляет бензилы и аллильную группу C—H соединений до карбонильных производных. Так, например, 2,4,6-тринитротолуол окисляется до соответствующих карбоновых солей. Кроме того, 2,3-диметинаптален (англ. 2,3-dimethylnaphthalene) окисляется в присутствии Na2Cr2O7 до 2,3-напталендикарбоксилиновой кислоты (англ. 2,3-naphthalenedicarboxylic acid).
Получение
Дихромат натрия образуется в больших масштабах из руд содержащих оксид хрома(III).
Сначала руду сплавляют, как правило, с карбонатом натрия при температуре около 1000 °C в присутствии воздуха (источник кислорода):
На данном этапе другие компоненты руды, такие как алюминий и железо, плохо растворимы. Окисление в результате реакции водного экстракта серной кислоты или углекислого газа дает дихромат натрия, который выделяется как дигидрат при кристаллизации. Соединения хромаVI являются токсичными, в частности, при получении в виде пыли производящие его заводы могут быть подвержены строгим правилам. Например, чтобы снизить его токсичность его сливают в сточные воды, где происходит восстановление с получением хромаIII, который является менее опасным для окружающей среды.
Использование
Используют при дублении кож и в электрических элементах.
Опасность применения
Как и все соединения шестивалентного хрома, дихромат натрия считается опасным. Кроме того, он известный канцероген. Вещество очень токсично для водных организмов, может вызвать долговременные изменения в водной экосистеме.
См. также
Ссылки
- Карточка вещества (рус.)
Соединения хромаБихромат аммония ((NH4)2Cr2O7) • Борид хрома (CrB) • Бромид хрома(II) (CrBr2) • Бромид хрома(III) (CrBr3) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексакарбонил хрома (Cr(CO)6) • Гидроксид хрома (III) (Cr(OH)3) • Гидроксид хрома(II) (Cr(OH)2) • Двухромовая кислота (H2Cr2O7) • Диоксид-дихлорид хрома (CrO2Cl2) • Дихромат калия (K2Cr2O7) • Дихромат лития (Li2Cr2O7) • Дихромат натрия (Na2Cr2O7) • Дихромат рубидия (Rb2Cr2O7) • Дихромат цезия (Cs2Cr2O7) • Зелень Гинье (Cr2O3•nH2O) • Иодид хрома(II) (CrI2) • Иодид хрома(III) (CrI3) • Карбид хрома(II) (Cr3C2) • Нитрат хрома (Cr(NO3)3) • Нитрид хрома (CrN) • Оксид хрома(II) (CrO) • Оксид хрома(III) (Cr2O3) • Оксид хрома(IV) (CrO2) • Оксид хрома(VI) (CrO3) • Оксифторид хрома(III) (CrOF) • Ортофосфат хрома(III) (CrPO4) • Пероксид хрома(VI) (CrO5) • Сульфат хрома(II) (CrSO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфид хрома(II) (CrS) • Сульфид хрома(III) (Cr2S3) • Сульфат хрома(III)-калия (KCr(SO4)2) Фосфат хрома (CrPO4) • Фосфид хрома (CrP) • Фторид хрома(II) (CrF2) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фтористый хромил (CrO2F2) • Хлорид гексаамминхрома(III) ([Сr(NH3)6]Cl3) • Хлорид хрома(II) (CrCl2) • Хлорид хрома(III) (CrCl3) • Хлорид хрома(IV) (CrCl4) • Хлористый хромил (CrO2Cl2) • Хромат аммония ((NH4)2CrO4) • Хромат калия (K2CrO4) • Хромат лития (Li2CrO4) • Хромат натрия (Na2CrO4) • Хромат рубидия (Rb2CrO4) • Хромат серебра (Ag2CrO4) • Хромат цезия (Cs2CrO4) • Хромит железа(II) (Fe(CrO2)2) • Хромит калия (KCrO2) • Хромовая кислота (H2CrO4) •
Категории:- Соединения натрия
- Соединения хрома
- Неорганические вещества
- Дихроматы
-
Wikimedia Foundation. 2010.






